Кроме того, автор просит прощения у читателей за вынужденное использование химических терминов — атрибутов науки (как показал собственный педагогический опыт, не самой любимой школьниками). Осознавая, что писать о химических веществах, не упоминая химических терминов, невозможно, автор попытается свести к минимуму специальную лексику.
И последнее. Приводимые автором цифровые данные отнюдь не следует считать истиной в последней инстанции. Данные по характеристикам ВВ в разных источниках отличаются и иногда довольно сильно. Это и понятно: характеристики боеприпасов весьма значительно зависят от их «товарного» вида, наличия/отсутствия посторонних веществ, введения стабилизаторов, режимов синтеза и многих других факторов. Методики определения характеристик ВВ тоже не отличаются однообразием (хотя тут как раз стандартизации будет побольше) да особой воспроизводимостью они тоже не страдают.
Классификация ВВВ зависимости от типа взрыва и чувствительности к внешним воздействиям все ВВ делят на три основные группы:
1. Инициирующие ВВ.
2. Бризантные ВВ.
3. Метательные ВВ.
Инициирующие ВВ. Они обладают высокой чувствительностью к внешним воздействиям. Остальные характеристики у них обычно невысоки. Но они обладают ценным свойством — их взрыв (детонация) оказывает детонационное воздействие на бризантные и метательные ВВ, которые обычно к остальным типам внешнего воздействия не чувствительны вовсе или же обладают очень низкой чувствительностью. Поэтому, инициирующие вещества и применяют только для возбуждения взрыва бризантных или метательных ВВ. Для обеспечения безопасности применения инициирующих ВВ, их упаковывают в защитные приспособления (капсюль, капсюльная втулка, капсюль-детонатор, электродетонатор, взрыватель). Типичные представители инициирующих ВВ: гремучая ртуть, азид свинца, тенерес (ТНРС).
Бризантные ВВ. Это, собственно и есть то, о чем говорят и пишут. Ими снаряжают снаряды, мины, бомбы, ракеты, фугасы; ими взрывают мосты, автомобили, бизнесменов…
Бризантные ВВ по их взрывным характеристикам делят на три группы:
— повышенной мощности (представители: гексоген, октоген, тэн, тетрил);
— нормальной мощности (представители: тротил, мелинит, пластит);
— пониженной мощности (представители: аммиачная селитра и ее смеси).
ВВ повышенной мощности несколько более чувствительны к внешним воздействиям и поэтому их чаще применяют в смеси с флегматизаторами (веществами, понижающими чувствительность ВВ) или в смеси с ВВ нормальной мощности для повышения мощности последних. Иногда ВВ повышенной мощности применяют в качестве промежуточных детонаторов.
Метательные ВВ. Это различные пороха — черный дымный, бездымные пироксилиновые и нитроглицериновые. К ним также относят различные пиротехнические смеси для фейерверков, сигнальных и осветительных ракет, осветительных снарядов, мин, авиабомб.
О черном порохе и Черном БертольдеНесколько веков единственным видом взрывчатки, которую использовал человек, был черный порох. С его помощью во врага из пушек метали ядра, им же начиняли разрывные снаряды. Порох использовали в подземных минах-подкопах для разрушения стен крепостей, для дробления скальных пород.
В Европе он стал известен с XIII века, а в Китае, Индии и Византии еще раньше. Первое зафиксированное описание пороха для фейерверков было описано китайским ученым Сунь-Сымяо в 682 г. Максимилиан Грек (XIII — XIV века) в трактате «Книга огней» описывал смесь на основе калийной селитры, применявшихся в Византии в качестве знаменитого «греческого огня» и состоящего из 60% селитры, 20% серы и 20% угля.

Европейская история открытия пороха начинается с англичанина, францисканского монаха Роджера Бекона, который в 1242 году в книге "Liber de Nullitate Magiae" приводит рецепт дымного пороха для ракет и фейерверков (40% селитры, 30% угля и 30% серы) и полумифического монаха Бертольда Шварца (1351 год). Впрочем, не исключено, что это был один человек: использование псевдонимов в Средние века было делом достаточно распространенным, так же, как и последующая путаница с датировкой источников.
Простота состава, доступность двух из трех компонентов (самородная сера и сейчас не редкость в южных районах Италии и на Сицилии), легкость приготовления — все это гарантировало пороху триумфальное шествие по странам Европы и Азии. Единственной проблемой было получение в больших количествах калийной селитры, но и с этой задачей успешно справились. Так как единственное известное в то время месторождение калийной селитры находилось в Индии (отсюда ее второе название — индийская), местное производство было налажено практически во всех странах. Назвать его приятным нельзя было, даже имея солидный запас оптимизма: сырьем для него служили навоз, внутренности животных, моча и шерсть животных. Наименее неприятными компонентами этой дурно пахнущей и сильно пачкавшейся смеси были известь и поташ. Все это богатство на несколько месяцев сваливалось в ямы, где бродило под действием азотобактерий. Выделявшийся аммиак окислялся до нитратов, которые в конечном счете давали вожделенную селитру, которую выделяли и очищали перекристаллизацией — занятие, тоже скажу, не из самых приятных. Как видим, ничего особо сложного в процессе нет, сырье вполне доступное и доступность пороха тоже вскоре стала всеобщей.
Черный (или дымный) порох в то время был универсальным ВВ. Ни шатко, ни валко, долгие годы он использовался и как метательное средство, и как начинка для первых бомб — прообразов современных боеприпасов. До конца первой трети XIX века порох полностью отвечал потребностям прогресса. Но наука и промышленность не стояли на месте, и вскоре он перестал отвечать требованиям времени из-за своей небольшой мощности. Конец монополии пороха можно отнести к 70-м годам XVII века, когда А.Лавуазье и К.Бертолле организовали производство бертолетовой соли на основе открытого Бертолле хлората калия (бертолетовой соли).
Историю бертолетовой соли можно начать отсчитывать от того момента, когда Клод Бертолле изучал свойства недавно открытого Карлом Шееле хлора. При пропускании хлора через горячий концентрированный раствор гидроксида калия Бертолле получил новое вещество, позднее названное химиками хлоратом калия, а не химиками — бертоллетовой солью. Произошло это в 1786 году. И хотя дьявольская соль так и не стала новой взрывчаткой, свою роль она выполнила: во-первых, послужила стимулом к поиску новых заменителей порядком одряхлевшего «бога войны», и во-вторых, стала родоначальником новых типов ВВ — инициирующих.
Взрывчатое масло
И вот в 1846 году химики предложили два новых взрывчатых вещества — пироксилин и нитроглицерин. В Турине итальянский химик Асканьо Собреро обнаружил, что достаточно обработать глицерин азотной кислотой (выполнить нитрование), чтобы образовалась маслянистая прозрачная жидкость — нитроглицерин. Первое печатное сообщение о нем было опубликовано в журнале «L’Institut» (XV, 53) от 15 февраля 1847 года и оно заслуживает некоторого цитирования. В первой ее части говорится:
«Асканьо Собреро, профессор технической химии с Турине, в письме, переданном проф. Пелузом, сообщает, что он давно уже получает взрывчатые вещества действием азотной кислоты на различные органические вещества, именно на тростниковый сахар, манит, декстрит, молочный сахар и др. Собреро также изучал действие смеси азотной и серной кислот на глицерин, и опыт показал ему, что получается вещество, подобное гремучему хлопку…»
Далее идет описание опыта нитрования, интересные только химикам-органикам (да и то только с исторической точки зрения), мы же только отметим одну особенность: нитропроизводные целлюлозы, как и их возможность взрываться, тогда тоже уже были достаточно хорошо известны [11].
Нитроглицерин является одним из самых мощных и чувствительных бризантных ВВ, обращение с которым требует особой внимательности и осторожности.
1. Чувствительность: от прострела пулей может взрываться. Чувствительность к удару 10 кг гирей, сбрасываемой с высоты 25 см — 100%. Горение переходит в детонацию.
2. Энергия взрывчатого превращения — 5300 Дж/кг.
3. Скорость детонации: 6500 м/сек.
4. Бризантность: 15-18 мм.
5. Фугасность: 360-400 куб. см [6].
Возможность использования нитроглицерина показал знаменитый русский химик Н.Н.Зинин, который в 1853—1855 годах во время Крымской войны вместе с военным инженером В.Ф.Петрушевским изготовил большое количество нитроглицерина.
 Профессор Казанского университета Н.Н. Зинин
Профессор Казанского университета Н.Н. Зинин Военный инженер В.Ф. Петрушевский
Военный инженер В.Ф. ПетрушевскийНо дьявол, живущий в нитроглицерине, оказался злобным и непокорным. Оказалось, что чувствительность этого вещества к внешним воздействиям лишь немногим уступает гремучей ртути. Он может взорваться уже в момент нитрования, его нельзя встряхивать, нагревать и охлаждать, выставлять на солнце. Он может взорваться в процессе хранения. А если его поджечь спичкой, может совершенно спокойно гореть...

И все же потребность в мощной взрывчатке к середине XIX века уже была столь велика, что, несмотря на многочисленные несчастные случаи, нитроглицерин стали широко использовать при взрывных работах.
Попытки обуздать злобного дьявола предпринимались многими, но слава укротителя досталась Альфреду Нобелю. Перипетии этого пути, равно как и судьба доходов от продажи этого вещества, достаточно широко известны, и вдаваться в их подробности автор считает излишним.
Будучи «втиснутым» в поры инертного наполнителя (а таковыми были перепробованы несколько десятков веществ, лучшим из которых оказалась инфузорная земля — пористый силикат, 90% объема которого приходится на поры, способные жадно впитывать нитроглицерин), нитроглицерин становился намного более «сговорчивым», сохраняя при себе почти всю свою разрушительную силу. Как известно, Нобель дал этой смеси, внешне похожей на торф, название «динамит» (от греческого слова «динос» — сила). Ирония судьбы: спустя год после получения Нобелем патента на производство динамита Петрушевский совершенно самостоятельно смешивает нитроглицерин с магнезией и получает взрывчатку, названную позднее «русским динамитом».
Нитроглицерин (а точнее, глицеринтринитрат) представляет собой полный сложный эфир глицерина и азотной кислоты. Получают его обычно получают путем обработки глицерина серно-азотной кислотной смесью (на химическом языке — реакция этерификации):
Взрыв нитроглицерина сопровождается выделением большого количества газообразных продуктов:
4 C3H5(NO2)3 = 12 CO2 + 10 H2O + 6 N2 + O2
Этерификация протекает последовательно в три ступени: в первой получается глицеринмононитрат, во второй — глицериндинитрат и в третьей — глицеринтринитрат. Для более полного выхода нитроглицерина берут 20%-ный избыток азотной кислоты сверх теоретически необходимого количества.
Нитрование проводилось в фарфоровых горшках или паяных свинцовых сосудах, стоящих в ванне с ледяной водой. За один заход получали около 700 г нитроглицерина, причем в течение часа таких операций производилось по 3 — 4.
Но возрастающие потребности вносили свои коррективы в технологию получения нитроглицерина. Со временем (в 1882 году) была разработана технология получения взрывчатки в нитраторах. При этом процесс разбили на два этапа: на первом глицерин смешивали с половинным количеством серной кислоты и тем самым утилизировали большую часть выделяющегося тепла, после чего в тот же сосуд вводилась готовая смесь азотной и серной кислот. Таким образом удалось избежать главной трудности: чрезмерного перегрева реакционной смеси. Перемешивание производится сжатым воздухом под давлением 4 атм. Производительность процесса — 100 кг глицерина за 20 мин при 10 — 12 градусах.
Благодаря различному удельному весу нитроглицерина (1,6) и отработанной кислоты (1,7) он собирается сверху с резкой поверхностью раздела. После нитрования нитроглицерин промывается водой, затем промывается от остатков кислоты содой и снова промывается водой. Перемешивание на всех стадиях процесса производится сжатым воздухом. Осушка производится путем фильтрования через слой прокаленной поваренной соли [9].
Как видно, реакция является достаточно простой (вспомним волну терроризма в конце XIX века, поднятую «бомбистами», освоившими несложную науку прикладной химии) и принадлежит к числу «несложных химических процессов» (А.Штетбахер). Сделать практически любое количество нитроглицерина можно в простейших условиях (изготовить черный порох не намного легче).
Расход реагентов следующий: для получения 150 мл нитроглицерина нужно взять: 116 мл глицерина; 1126 мл концентрированной серной кислоты;
649 мл азотной кислоты (не менее 62% концентрации).
Динамит на войне
Динамит впервые использовался во Франко-прусской войне 1870—1871 годов: прусские саперы взрывали динамитом французские фортификационные сооружения. Но безопасность динамита оказалась относительной. Военные моментально выяснили, что при простреле пулей он взрывается не хуже своего прародителя, а горение в определенных случаях переходит во взрыв.
Но соблазн получения мощного боеприпаса был непреодолим. Путем довольно опасных и сложных экспериментов удалось выяснить, что динамит не будет детонировать, если нагрузки будут возрастать не мгновенно, а постепенно, удерживая ускорение снаряда в безопасных рамках.
Решение проблемы на техническом уровне увидели в применении сжатого воздуха. В июне 1886 года лейтенант Эдмунд Людвиг Г. Зелинский из 5-го артиллерийского полка армии Соединенных Штатов провел испытания и усовершенствовал оригинальную разработку компании «Америкэн инжиниринг». Пневматическая пушка калибром 380 мм и длиной 15 м с помощью воздуха, сжатого до 140 атм, могла метать снаряды длиной в 3,35 м с 227 кг динамита на 1800 м. А снаряд длиной 1,8З м с 51 кг динамита и на все 5 тыс. м.
Движущая сила обеспечивалась двумя баллонами со сжатым воздухом, причем верхний из них был связан с орудием гибким шлангом. Второй баллон был резервом для питания верхнего, причем давление в нем самом поддерживалось с помощью зарытого в землю парового насоса. Начиненный динамитом снаряд имел форму дарта — артиллерийской стрелы — и имел 50-фунтовую боеголовку.
Герцог Кембриджский распорядился о проведении армией испытаний одной такой системы в Милфорд-Хейвене, однако орудие израсходовало почти все боеприпасы, прежде чем наконец поразило цель, которая, впрочем, была уничтожена весьма эффективно. Американские адмиралы пришли в восторг от новой пушки: в 1888 году были отпущены деньги на изготовление 250 динамитных орудий для береговой артиллерии.
В 1885 году Зелинский учредил фирму «Pneumatic Gun Company» для внедрения в армии и на флоте пневматических орудий с динамитными снарядами. Его эксперименты заставили говорить о пневматических пушках как о новом перспективном оружии. Флот США даже построил в 1888 году динамитный крейсер «Везувий», водоизмещением 944 тонны, вооруженный тремя такими орудиями калибра 381 мм.
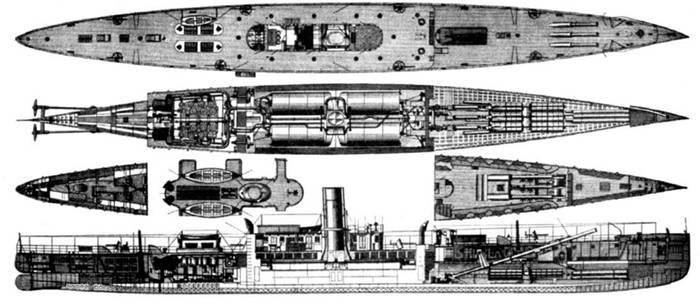 Схема "динамитного" крейсера "Везувий"
Схема "динамитного" крейсера "Везувий"[center]

[/center]
Но странное дело: через несколько лет энтузиазм сменился разочарованием. «Во время испано-американской войны, — говорили по этому поводу американские артиллеристы, — эти пушки ни разу не попали куда нужно». И хотя дело тут было не столько в пушках, сколько в умении артиллеристов метко стрелять и жестком креплении орудий, дальнейшего развития эта система не получила.
В 1885 году Холланд установил на своей субмарине № 4 пневматическую пушку Зелинского. Однако до ее практических испытаний дело не дошло, т.к. лодка потерпела серьезную аварию во время спуска на воду.
В 1897 году Холланд вновь вооружил новой пушкой Зелинского свою подводную лодку № 8. Вооружение было представлено носовым торпедным аппаратом калибра 18 дюймов (457 мм) с тремя торпедами Уайтхеда, а также кормовой пневматической пушкой Зелинского для динамитных снарядов (боекомплект 7 снарядов по 222 фунта (100,7 кг) каждый). Однако из-за слишком короткого ствола, ограниченного размерами лодки, эта пушка имела небольшую дальность стрельбы. После практических стрельб изобретатель в 1899 году демонтировал ее.
В дальнейшем ни Холланд, ни другие конструкторы не устанавливали пушки (аппараты) для стрельбы метательными минами и динамитными снарядами на своих субмаринах. Так пушки Зелинского незаметно, но быстро сошли со сцены [12].
Родной брат нитроглицеринаС химической точки зрения глицерин является простейшим представителем класса трехатомных спиртов. Существует его двухатомный аналог — этиленгликоль. Стоит ли удивляться, что после знакомства с нитроглицерином химики обратили внимание и на этиленгликоль, рассчитывая, что он окажется более удобным в применении.
Но и здесь дьявол взрывчатки показал свой капризный характер. Характеристики динитроэтиленгликоля (своего собственного названия это ВВ так и не получило) оказались мало чем отличающимися от нитроглицерина:
1. Чувствительность: детонация при падении 2 кг груза с высоты 20 см; чувствителен к трению, огню.
2. Энергия взрывчатого превращения — 6900 Дж/кг.
3. Скорость детонации: 7200 м/сек.
4. Бризантность: 16,8 мм.
5. Фугасность: 620—650 куб. см.
Впервые был получен Генри в 1870 г. Получают осторожным нитрованием этиленгликоля по методике, сходной с получением нитроглицерина (нитрующая смесь:
H2SO4 — 50%,
HNO3 — 50%; соотношение — 1 к 5 по отношению к этиленгликолю).
Процесс нитрования можно вести при более низкой температуре, что является предрасположением к более высокому выходу [7, 8].
Несмотря на то, что в целом чувствительность ДНЭГ оказалась несколько ниже, чем у НГ, существенных выгод его применение не сулило. Если добавить к этому еще и более высокую, чем у НГ, летучесть и меньшую доступность исходного сырья, то становится ясным, что и этот путь вел в никуда.
Впрочем, совсем уж бесполезным он тоже не оказался. Вначале его применяли как добавку к динамиту, в годы второй мировой войны, вследствие нехватки глицерина, использовали в качестве заменителя нитроглицерина в бездымных порохах. Такие пороха имели малые сроки хранения из-за летучести ДНЭГ, однако в условиях военного времени это особого значения не имело: долго хранить их никто не собирался.
Фартук Христиана ШенбайнаНеизвестно, сколько времени потратили бы военные на поиски путей успокоения нитроглицерина, если бы к концу XIX века не подоспела промышленная технология получения еще одного нитроэфира. Вкратце история его появления выглядит следующим образом [16].
В 1832 году французский химик Анри Браконно обнаружил, что при обработке крахмала и древесных волокон азотной кислотой образуется нестойкий горючий и взрывоопасный материал, который он назвал ксилоидин. Правда, сообщением об этом открытии дело и ограничилось. Шестью годами позднее, в 1838 году, другой французский химик, Теофиль-Жуль Пелуз, обработал подобным образом бумагу и картон и получил похожий материал, названный им нитрамидин. Кто бы мог тогда подумать, но причиной невозможности использования нитрамидина в технических целях была как раз именно его низкая стабильность.
В 1845 году уже швейцарский химик Христиан Фридрих Шенбайн (прославившийся к тому времени открытием озона) проводил опыты в своей лаборатории. Жена строго-настрого запретила ему приносить свои колбы на кухню, поэтому он спешил закончить опыт в ее отсутствие — и пролил немного едкой смеси на стол. Стремясь избежать скандала, он, в лучших традициях швейцарской аккуратности, вытер его своим рабочим фартуком, благо смеси было не слишком много. Затем, тоже в традициях швейцарской бережливости, он промыл фартук водой и повесили сушиться над печкой. Долго ли, коротко ли он там висел, история умалчивает, но вот о том, что после высыхания фартук неожиданно исчез, известно доподлинно. Причем, исчез он не тихо, по-английски, а громко, можно сказать даже феерически: в вспышке и громком хлопке взрыва. Но вот что привлекло внимание Шенбайна: взрыв произошел без малейшей струйки дыма!
И хотя Шенбайн и не был первым, кто открыл нитроклетчатку, сделать вывод о важности открытия суждено было именно ему. В то время в артиллерии использовали черный порох, сажа от которого так пачкала орудия, что в перерывах между выстрелами их приходилось чистить, а уже после первых залпов поднималась такая завеса дыма, что сражаться приходилось чуть ли не вслепую. Что уже говорить о том, что клубы черного дыма прекрасно обозначали место расположения батарей. Единственное, что скрашивало жизнь — это осознание того, что и противник находился в том же положении. Поэтому к взрывчатому веществу, дающему значительно меньше дыма, да к тому же еще и более сильному, чем черный порох, военные отнеслись с энтузиазмом.
Нитроцеллюлоза, лишенная недостатков черного пороха, позволяла наладить производство пороха бездымного. И, в традициях того времени, использовать его решили и в качестве метательного вещества, и в качестве взрывчатки. В 1885 году после многочисленных экспериментальных работ французский инженер Поль Вьель получил и испытал несколько килограмм пироксилинового пластинчатого пороха, получившего название пороха "B" — первого бездымного пороха. Испытания доказали преимущества нового пороха.
Однако наладить производство большого количества нитроклетчатки для военных нужд было непросто. Нитроцеллюлоза была слишком нетерпелива, чтобы дожидаться сражений и фабрики, как правило, с завидной регулярностью взлетали на воздух, как бы соперничая в этом с нитроглицериновым производством. При создании технологии промышленного производства пироксилина пришлось преодолеть такие препятствия, как ни для одного другого взрывчатого вещества. Потребовалась целая четверть века на выполнение ряда работ исследователями разных стран, пока это оригинальное волокнистое взрывчатое вещество сделалось пригодным для применения и пока были найдены многочисленные средства и способы, которые сколько-нибудь гарантировали от взрыва при продолжительном хранении продукта. Выражение «сколько-нибудь» не литературный прием, а отражение той сложности, с которой столкнулись химики и технологи при определении критериев устойчивости. Твердого суждения о подходах к определению критериев устойчивости не было, а при дальнейшем расширении сферы использования этого взрывчатого вещества постоянные взрывы обнаруживали все новые и новые загадочные особенности в поведении этого своеобразного сложного эфира. Лишь в 1891 году Джеймсу Дьюару и Фредерику Абелю удалось найти безопасную технологию.
Производство пироксилина требует большого количества вспомогательных аппаратов и длительного технологического процесса, в котором все операции должны производиться одинаково тщательно и основательно.
Исходным продуктом для производства пироксилина является целлюлоза, наилучшим представителем которой является хлопок. Природная чистая целлюлоза представляет собой полимер, состоящий из остатков глюкозы, являясь близкой родственницей крахмала:
(C6H10O5)n. Кроме того, источником отличного сырья могут стать отходы бумагопрядильных фабрик.
Нитрование клетчатки было освоено в промышленных масштабах еще в 60-х годах XIX века и проводилось в керамических горшках с дальнейшим отжимом в центрифугах. Однако к концу века этот примитивный способ был вытеснен американской технологией, хотя в годы ПМВ был возрожден ввиду невысокой стоимости и простоты (точнее, примитивизма).
Очищенный хлопок загружается в нитратор, добавляется нитрующая смесь (HNO
3<!--sizeend--><!--/sizeend--> — 24%, H
2SO
4 — 69%, вода — 7%) из расчета на 15 кг клетчатки 900 кг смеси, что дает выход 25 кг пироксилина.
Нитраторы соединены в батареи, состоящие из четырех реакторов и одной центрифуги. Загрузка нитраторов производится с временным интервалом (приблизительно 40 мин), равным времени отжима, чем обеспечивается непрерывность процесса.
Пироксилин представляет собой смесь продуктов различной степени нитрования целлюлозы. Пироксилин, полученный при использовании вместо серной кислоты фосфорной, отличается высокой стабильностью, но такая технология не прижилась ввиду более высокой стоимости и меньшей производительности.
Отжатый пироксилин имеет свойство самовоспламеняться и нуждается в увлажнении. Вода, применяемая для промывки и стабилизации пироксилина, не должна содержать щелочных агентов, так как продукты щелочной деструкции являются катализаторами самовоспламенения. Окончательная сушка до необходимой влажности достигается промывкой абсолютным спиртом.
Но и увлажненная нитроцеллюлоза не свободна от неприятностей: она подвержена заражению микроорганизмами, которые вызывают появление плесени. Предохраняют ее путем парафинирования поверхности. Готовый продукт имел такие характеристики:
1. Чувствительность пироксилина сильно зависит от влажности. Сухой (3 — 5% влаги) легко загорается от открытого пламени или прикосновения раскаленного металла, сверления, трения. Взрывается от падения груза 2 кг с высоты 10 см. При повышении влажности чувствительность снижается и при 50% воды способность к детонации пропадает.
2. Энергия взрывчатого превращения — 4200 МДж/кг.
3. Скорость детонации: 6300 м/сек.
4. Бризантность: 18 мм.
5. Фугасность: 240 куб. см.
И все же, несмотря на недостатки, химически более устойчивый пироксилин устраивал военных больше, чем нитроглицерин и динамит, его чувствительность можно было регулировать, меняя его влажность. Поэтому прессованный пироксилин начал находить себе широкое применение для снаряжения боевых частей мин и снарядов, однако со временем этот не имевший себе равных продукт уступил пальму первенства нитрованным производным ароматических углеводородов. Нитроклетчатка осталась в качестве метательного ВВ, но как бризантное ВВ навсегда отошла в прошлое [9].
Гремучий студень и нитроглицериновый порох«Черный порох… представляет все задатки дальнейшего усовершенствования — при помощи научного исследования невидимых явлений, совершающихся при его горении. Бездымный порох составляет новое звено между могуществом стран и научным их развитием. По этой причине, принадлежа к числу ратников русской науки, я на склоне сил и лет не осмеливаюсь от разбора задач бездымного пороха…»
Читатель, хоть немного знакомый с историей химии, вероятно уже догадался, чьи это слова — гениального русского химика Д.И.Менделеева.
Пороходелию как области химических знаний Менделеев уделял много сил и внимания в последние годы своей жизни — в 1890—1897 годах. Но, как всегда, активной фазе разработок предшествовал период размышлений, накопления и систематизации знаний.
А началось все с того, что в 1875 году неутомимый Альфред Нобель сделал еще одно открытие: пластичный и эластичный твердый раствор нитроклетчатки в нитроглицерине. В нем довольно удачно сочетались твердая форма, высокая плотность, простота формовки, концентрированная энергия и нечувствительность к высокой влажности атмосферы. Студень, нацело сгоравший в углекислый газ, азот и воду, состоял на 8% из динитроцеллюлозы и 92% нитроглицерина.
В отличии от технаря Нобеля, Д.И. Менделеев исходил из сугубо научного подхода. В основу своих изысканиях он положил вполне определенную и химически строго обоснованную идею: искомое вещество при горении должно выделять максимум газообразных продуктов на единицу веса. С химической точки зрения это значит, что кислорода в этом соединении должно хватить для полного превращения углерода в газообразный оксид, водорода — в воду, а окислительной способности — для обеспечения энергией всего этого процесса. Подробный расчет привел к формуле следующего состава:
C30Н38(NO2)12O25. При горении должно получиться следующее:
C30Н38(NO2)12O25 = 30 СO + 19 H2O + 6 N2
Осуществить целенаправленную реакцию синтеза вещества такого состава даже в настоящее время является непростой задачей, поэтому на практике применялась смесь состава 7 – 10% нитроклетчатки и 90 – 93 % нитроглицерина. Процент содержания азота — около 13,7%, что немного превышает этот показатель для пироколлодия (12,4%). Операция не представляет особой сложности, не требует применения сложного оборудования (проводится в жидкой фазе) и протекает при обычных условиях.
В 1888 году Нобель получил патент на порох из нитроглицерина и коллоксилина (низконитрованной клетчатки), названный подобно пироксилиновому пороху бездымным. Этот состав практически без изменений используется до настоящего времени под различными техническими названиями, самые известные из которых кордит и баллистит. Основное отличие — в соотношении между нитроглицерином и пироксилином (у кордита оно больше) [13].
Как же соотносятся между собой эти ВВ? Обратимся к таблице:
Таблица 1.
---------------------------------------------------------------------------------
ВВ......Чувствительность....Энергия...Скорость......Бризантность...Фугасность
.........(кг/см/%взрывов)....взрыва....детонации
--------------------------------------------------------------------------------------
ГН..........2/4/100............5300........6500...........15 - 18...........360 - 400
ДНЭГ......2/10/100...........6900.........7200..........16,8...............620 - 650
НК.........2/25/10............4200.........6300...........18.................240
--------------------------------------------------------------------------------------
Характеристики всех ВВ довольно близки, но различие в физических свойствах диктовали разные ниши их применения.
Как мы уже видели, ни нитроглицерин, ни пироксилин не радовали военных своим характером. Причина низкой стабильности этих веществ, как мне кажется, лежит на поверхности. Оба соединения (или три — считая и динитроэтиленгликоль) являются представителями класса эфиров. А сложноэфирная группировка отнюдь не относится к лидерам химической стойкости. Уж скорее ее можно встретить среди аутсайдеров. Нитрогруппа, содержащая азот в довольно странной для него степени окисления +5, тоже не образец устойчивости. Симбиоз этого сильного окислителя с таким хорошим восстановителем, как гидроксильная группа спиртов, неизбежно приводит к ряду негативных последствий, самое неприятное из которых — капризность в применении.
Почему же химики и военные тратили столько времени на эксперименты с ними? Как видится, подкупало многое и многих. Военных — большая мощность и доступность сырья, что повышало боеспособность армии и делало ее малочувствительной к поставам в военное время. Технологов — мягкие условия синтеза (отсутствие необходимости применения высоких температур и повышенного давления) и технологические удобства (несмотря на многостадийность процессов, все реакции протекают в одном реакционном объеме и без необходимости выделения промежуточных продуктов).
Довольно высокими были и практические выходы продуктов (табл. 2), что не вызывало острой необходимости в поисках источников большого количества дешевой азотной кислоты (с серной кислотой вопрос был решен гораздо раньше).
Таблица 2.
-----------------------------------------------------------------------------------
ВВ......Расход реактивов на 1 кг.....К-во стадий....К-во выделяемых продуктов
.........Азотная к-та..Серная к-та
-----------------------------------------------------------------------------------
ГН.......10.................23.................3........................1
ДНЭГ....16,5..............16,5...............2........................1
НК........8,5...............25.................3........................1
-----------------------------------------------------------------------------------
Ситуация сильно изменилась, когда на сцену вышли новые ипостаси дьявола взрывчатки: тринитрофенол и тринитротолуол.
(Продолжение следует)
Вас заинтересует
Нитраты на войне. Часть II. Горький мёд и почти детективная история
Вместо пороха – заряд взрывчатого вещества
Как утилизируется химическое оружие
Укрощение дьявола
Укрощение дьявола



